骨肉腫における股関節部位の症状と治療方針
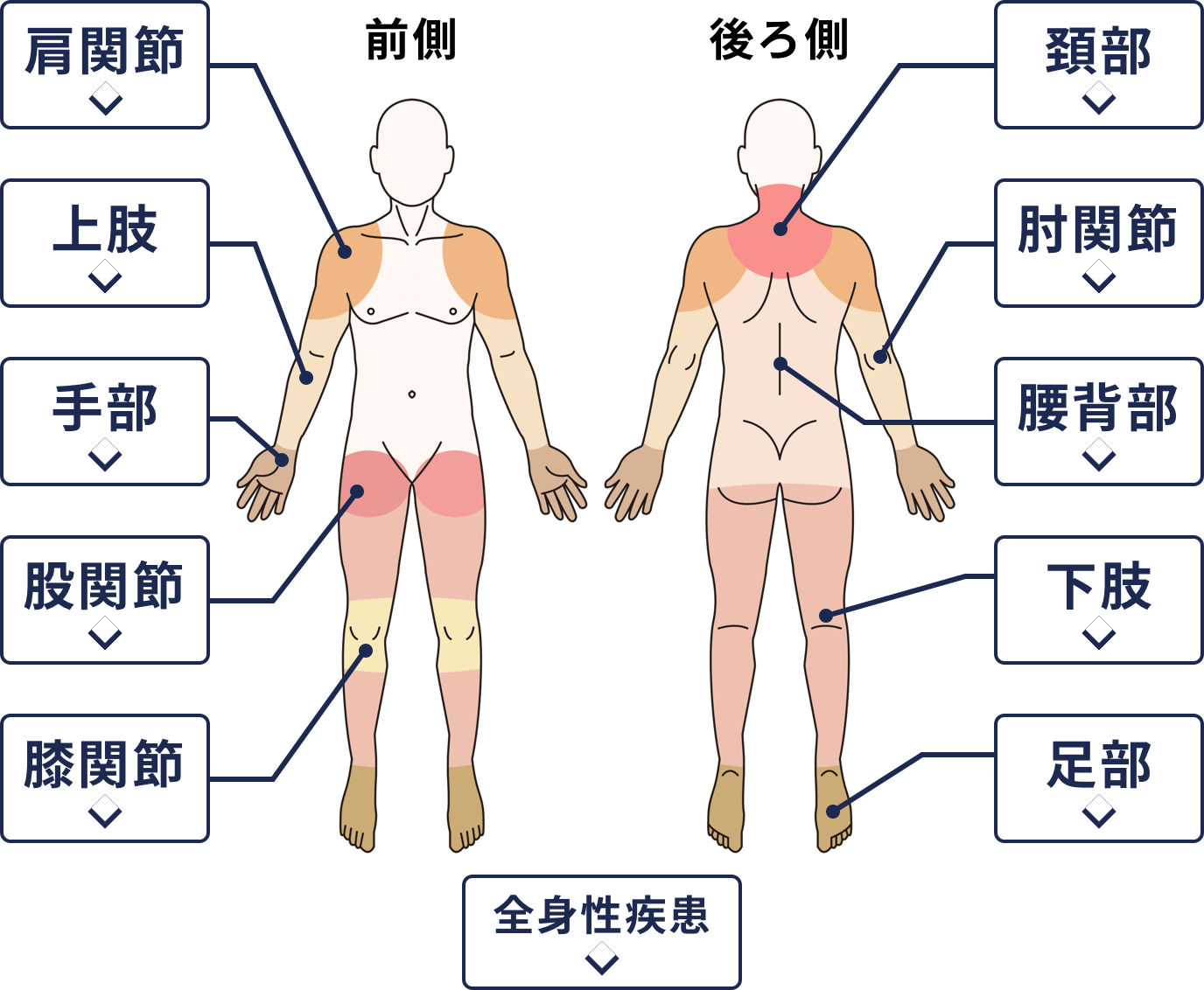
骨肉腫は骨に発生する悪性腫瘍の中で最も頻度が高く、特に股関節周辺(大腿骨近位部や骨盤)での発症は、膝関節周辺に次いで多く見られます。
この部位は身体の深部にあるため初期症状を自覚しにくく、発見時には腫瘍がある程度の大きさになっている場合も少なくありません。
治療方針は、抗がん剤による化学療法と手術療法を組み合わせる集学的治療が標準的です。
特に股関節は体重を支える重要な荷重関節であるため、腫瘍の根治性を確保しつつ、いかに歩行機能を温存するかが治療計画の要となります。
本記事では、股関節領域の骨肉腫に特化した症状の特徴、診断の流れ、そして治療戦略について詳細に解説します。
目次
股関節周辺に発生する骨肉腫の基礎知識と疫学的特徴
股関節周辺、特に大腿骨近位部や骨盤に発生する骨肉腫は、10代から20代の若年層に好発し、深部にあるため発見が遅れやすいという特徴があります。
初期症状を筋肉痛や成長痛と誤認しやすい傾向があるため、年齢や痛みの持続性を慎重に見極めることが早期発見の鍵となります。
大腿骨近位部および骨盤における発生頻度
骨肉腫全体の発生部位を見ると、膝関節周辺(大腿骨遠位、脛骨近位)が全体の約6割を占めますが、股関節周辺(大腿骨近位、骨盤)もそれに次ぐ好発部位として重要です。
大腿骨近位部は約1割から2割程度を占めると考えられ、骨盤発生のものを含めると股関節機能に影響を及ぼす症例は決して稀ではありません。
大腿骨近位部に発生した場合、股関節の曲げ伸ばしや体重支持に直接的な影響を与えるため、早期から歩行時の違和感が生じることがあります。
若年層における発症傾向と細胞の活動
骨肉腫は骨の成長が活発な時期に発生しやすいという特徴を持ちます。
これは骨が伸びるための細胞分裂が盛んに行われている成長軟骨板(骨端線)の近くで、細胞の遺伝子変異が起こりやすくなるためと推測できます。
股関節周辺の大腿骨近位部も骨の成長を担う重要な部分であり、身長が急激に伸びる思春期に発症のピークを迎えます。
年代別および部位別の特徴的な傾向
| 年代・区分 | 股関節周辺での特徴 | 臨床上の留意点 |
|---|---|---|
| 10代(成長期) | 大腿骨近位部での発生が多く、急速な骨成長と関連して細胞分裂が活発な部位に好発します。 | スポーツ障害や成長痛との鑑別が必要です。夜間痛の有無が重要な判断材料となります。 |
| 20代〜30代 | 若年層に次いで発生が見られます。社会活動が活発なため、治療による機能障害への配慮が重要です。 | 仕事や家庭生活への影響を考慮し、治療後のADL(日常生活動作)確保を計画します。 |
| 40代以降 | 原発性は減少しますが、他部位からの転移や、既存の骨疾患(ページェット病など)からの二次性骨肉腫を考慮します。 | 全身状態の評価とともに、骨盤発生など治療難易度の高いケースへの対応を検討します。 |
この時期の若者は部活動などのスポーツ活動も活発であるため、股関節の痛みを「運動のしすぎ」や「怪我」と捉えてしまい、受診が遅れるケースが散見されます。
痛みが長引く場合は、単なる整形外科的な外傷だけでなく、腫瘍性の病変も視野に入れることが大切です。
一方、骨盤に発生した場合は、内臓器との位置関係も近く、手術による切除範囲の決定が非常に複雑になります。
遺伝的要因と環境要因の関与
多くの骨肉腫は明らかな原因が特定できない散発的な発生ですが、一部の症例では遺伝的な素因が関与していることが知られています。
例えば、網膜芽細胞腫の治療歴がある場合や、リ・フラウメニ症候群などの遺伝性疾患を持つ家系では、骨肉腫の発症リスクが高い傾向にあります。
股関節周辺の骨肉腫においても、これらの背景因子を確認することは診断の一助となります。
しかし、大多数の患者において明確な遺伝性は認められず、偶然の遺伝子変異の蓄積によって発生すると考えます。
したがって、過度に遺伝を心配するよりも、現在の症状に対して迅速かつ適切な医療介入を行うことが優先事項です。
初期段階から進行期における自覚症状の推移
股関節部位の骨肉腫の症状は、初期の軽微な違和感から始まり、進行すると安静時痛や夜間痛といった持続的な痛み、さらには可動域制限や跛行といった機能障害へと変化していきます。
持続する疼痛と夜間痛の特徴
最も注意すべき症状は痛みです。初期は運動時や歩行時に股関節付近に痛みを感じ、休息すると和らぐ場合があります。
しかし、病状が進行し腫瘍が骨皮質を破壊して周囲に浸潤し始めると、活動量に関係なく痛みが生じるようになります。これを「安静時痛」と呼びます。
特に特徴的なのが「夜間痛」です。
夜、布団に入って身体を休めているにもかかわらず、ズキズキとした痛みが続き、睡眠が妨げられるような場合は、骨肉腫を含む悪性骨腫瘍の可能性を強く疑います。
股関節周辺の骨肉腫で警戒すべき身体的サイン一覧
- 1週間以上続く股関節の痛みが、湿布を貼ったり安静にしたりしても改善が見られない場合。
- 運動中だけでなく、夜寝ている時や、家でリラックスしている時にも奥深い痛みを感じる場合。
- お尻や太ももの付け根の深い部分に、これまでになかった硬いしこりや腫れを感じる場合。
- 原因不明の発熱が続いたり、ダイエットをしていないのに体重が減少したり、全身の倦怠感を伴う場合。
- 歩行時に無意識に足を引きずるようになり、股関節の曲げ伸ばしが困難になった場合。
成長痛であれば、さすったり温めたりすることで痛みが和らぐことが多いですが、骨肉腫の痛みは鎮痛剤を服用しなければ治まらないほど強くなることがあります。
これらのサインを見逃さず、早期に専門医の診察を受けることが、患肢温存率を高め、生命予後を改善するために極めて重要です。
可動域制限と跛行(はこう)の出現
腫瘍が増大すると、股関節の動きが物理的に制限されます。これを可動域制限と呼びます。
例えば、あぐらがかきにくくなったり、靴下を履く動作で股関節に鋭い痛みを感じたりするようになります。
また、痛みや関節の動かしにくさを避けるために、無意識のうちに足をかばって歩くようになり、歩き方が不自然になります。
これを逃避性跛行(とうひせいはこう)と呼びます。股関節は体重を支える要であるため、少しの機能障害でも歩行に大きな影響が出ます。
家族や周囲の人が「最近歩き方がおかしい」「足を引きずっている」と気づくことで受診につながるケースも少なくありません。
病的骨折による急激な発症
骨肉腫によって骨が破壊されると、骨の強度が著しく低下します。
この状態になると、転倒などの大きな外力が加わらなくても、歩行や立ち上がりといった日常の些細な動作だけで骨折してしまうことがあります。
これを病的骨折と呼びます。大腿骨近位部は体重の負荷が集中する場所であるため、病的骨折のリスクが高い部位です。骨折を起こすと激痛が生じ、歩行不能となります。
骨折を契機にレントゲンを撮り、初めて骨肉腫が見つかることもありますが、骨折を起こす前に発見し治療を開始することが、その後の患肢機能温存の観点から強く望まれます。
確定診断に至るまでの検査体系と病期分類
確定診断には、レントゲン、MRI、CTなどの画像診断による詳細な評価と、生検による組織学的診断の双方が不可欠であり、これらを統合して病期(ステージ)を決定し、治療計画を策定します。
画像診断による局所評価と全身検索
画像診断は、腫瘍の広がりや性質を把握するために必要です。
単純X線では、骨の内部が溶けている像(骨融解像)や、骨の外に新たに骨が作られている像(骨形成像)、あるいは骨膜反応(コッドマン三角など)といった特徴的な所見を確認します。
主要な検査方法とその目的
| 検査種別 | 実施方法 | 主な目的と得られる情報 |
|---|---|---|
| 単純X線検査(レントゲン) | X線を照射して骨の形態を撮影します。 | 骨の破壊像や異常な骨形成、骨膜反応の有無を確認し、骨肉腫の可能性をスクリーニングします。 |
| MRI検査(磁気共鳴画像) | 磁気を利用して断層画像を撮影します。 | 腫瘍の正確な範囲、筋肉や血管・神経への浸潤度合いを評価します。手術計画に必須の情報源です。 |
| 胸部CT検査・PET-CT | X線や放射性薬剤を用いて全身を撮影します。 | 肺転移の有無や、他の骨への転移がないかを全身的に検索し、病期(ステージ)を決定します。 |
MRIは、骨の中での腫瘍の広がりや、周囲の筋肉・血管・神経への浸潤状況を詳細に評価するために極めて有用です。
特に股関節周囲は血管や神経が複雑に走行しているため、手術計画を立てる上でMRIの情報は不可欠です。
CTは骨の破壊状況を詳細に見るほか、胸部CTを撮影することで肺への転移がないかを調べます。
また、骨シンチグラフィやPET-CTを用いて、全身の骨や他の臓器への転移の有無を網羅的に検索します。
生検(バイオプシー)による確定診断
画像検査で骨肉腫が強く疑われたとしても、顕微鏡で細胞を確認しなければ確定診断とはなりません。
生検には、太い針を刺して組織を採取する針生検と、皮膚を切開して組織を採取する切開生検があります。
骨肉腫の生検は、後の手術で切除するラインを考慮して行う必要があるため、非常に高度な専門性が求められます。
もし不適切な位置で生検を行ってしまうと、腫瘍細胞を周囲に撒き散らしてしまい、後の患肢温存手術が困難になるリスクがあります。
そのため、生検は骨軟部腫瘍の専門医が在籍する施設で行うことが推奨されます。
採取した組織を用いて、細胞の異型度や分裂の活発さなどを病理医が診断し、骨肉腫の種類(骨形成性、軟骨芽細胞性など)を特定します。
治療の中核を担う化学療法(抗がん剤治療)の役割
化学療法は、微小転移を制御して全身的な治癒を目指すとともに、原発巣を縮小させて安全な外科的切除を可能にするため、手術の前後に行うことが標準治療となっています。
術前化学療法の意義と効果判定
手術の前に行う化学療法には、いくつかの重要な目的があります。第一に、全身に潜んでいる可能性のある微小転移を早期に治療し、転移の芽を摘むことです。
第二に、原発巣の腫瘍を縮小させ、周囲の組織との境界を明瞭にすることです。その結果、手術での切除範囲を安全に確保しやすくなり、患肢温存の可能性が高まります。
標準的な治療スケジュールの構成
| 治療段階 | 期間の目安 | 主な実施内容と目的 |
|---|---|---|
| 術前化学療法 | 約2ヶ月〜3ヶ月 | 多剤併用による全身治療を行い、微小転移の抑制と原発巣の縮小、腫瘍周囲の浮腫軽減を目指します。 |
| 広範切除術 | 化学療法終了後 | 腫瘍を含めて安全域を確保した切除を行います。同時に人工関節などを用いた再建手術を実施します。 |
| 術後化学療法 | 約4ヶ月〜6ヶ月 | 術前治療の効果判定に基づき、残存する可能性のある微小な腫瘍細胞を根絶し、再発予防を徹底します。 |
第三に、使用した抗がん剤がその患者の腫瘍に対してどれくらい効果があったかを、手術で摘出した腫瘍の壊死率(細胞がどれくらい死滅したか)を見ることで判定できます。
術前化学療法の効果が高かった場合は、術後も同じ薬剤を使用し、効果が不十分だった場合は薬剤の変更を検討するなど、術後の治療戦略を立てる上での重要な指標となります。
多剤併用療法の実践
骨肉腫の化学療法では、単独の薬剤ではなく、作用機序の異なる複数の抗がん剤を組み合わせて使用する多剤併用療法を行います。
現在、標準的に使用される薬剤は、メトトレキサート、ドキソルビシン(アドリアマイシン)、シスプラチン、イホスファミドなどが挙げられます。
これらを組み合わせることで、相乗効果を狙いつつ、薬剤耐性(がん細胞が薬に慣れてしまうこと)の出現を防ぎます。
治療期間は数ヶ月から半年以上に及ぶことが多く、副作用の管理も重要になります。
吐き気、脱毛、骨髄抑制(白血球や血小板の減少)などの副作用に対し、制吐剤やG-CSF製剤(白血球を増やす薬)などの支持療法を適切に行いながら、治療の完遂を目指します。
股関節機能を温存するための広範切除と再建手術
手術療法では、腫瘍を完全に切除する広範切除術と、失われた股関節機能を再建するための腫瘍用人工関節置換術等を組み合わせ、根治性と機能温存の両立を図ります。
患肢温存手術と腫瘍用人工関節
腫瘍を切除した後の欠損部分をどのように修復するかが、術後の生活の質(QOL)を左右します。
大腿骨近位部の骨肉腫の場合、腫瘍用人工関節(腫瘍用人工骨頭や人工股関節)を用いた再建が一般的です。
これは、切除した骨の長さに合わせて特注やモジュール式の人工関節を挿入し、関節機能を再建する方法です。
手術治療において重視される優先目標
- 局所制御の徹底:腫瘍を完全に取りきり、局所での再発を防ぐことを最優先とします。
- 生命予後の改善:手術と化学療法の相乗効果により、生存率の最大化を目指します。
- 患肢機能の温存:可能な限り自分の足を残し、歩行能力を維持することを目指します。
- 痛みの除去:腫瘍による激しい痛みを取り除き、安楽な生活を送れるようにします。
- 整容性の配慮:傷跡や変形を可能な限り目立たなくし、精神的な負担を軽減します。
通常の人工股関節置換術と異なり、筋肉や腱も広範囲に切除している場合が多いため、関節の安定性を保つための工夫が必要です。
また、切除範囲が骨盤に及ぶ場合は、骨盤用の特殊な人工関節を使用したり、処理した自分の骨を戻す方法などを検討したりしますが、技術的な難易度はさらに上がります。
現代の医療技術では、可能な限り患肢を温存する縮小手術や再建技術が進化しています。
切断術の選択と適応
化学療法や画像診断の進歩により患肢温存率は向上していますが、依然として切断術が必要となるケースも存在します。
主要な神経や血管が腫瘍に完全に取り囲まれており、これらを温存して腫瘍を切除すると再発のリスクが極めて高くなる場合や、感染などで人工関節が入れられない場合、あるいは術後の機能が著しく低下し、義足の方が歩行機能が良いと判断される場合などです。
股関節離断や骨盤切断といった手術になりますが、生命を救うための確実な手段として選択します。
どのような術式を選択するかは、腫瘍の広がりだけでなく、患者の年齢、ライフスタイル、価値観を総合的に考慮し、医師と患者、家族が十分に話し合って決定します。
術後の身体機能回復と社会復帰に向けたリハビリテーション
リハビリテーションは、段階的な荷重訓練と日常生活動作(ADL)の獲得を中心に進められ、特に人工関節の脱臼予防や歩行能力の再獲得に向けて、専門的なプログラムが必要となります。
荷重開始の時期と歩行訓練
骨や人工関節の固定性が安定するまでは、手術した足に体重をかけること(荷重)が制限される場合があります。
主治医の指示に従い、免荷(体重をかけない)、部分荷重(体重の一部をかける)、全荷重(体重全体をかける)と段階的に進めます。
最初は平行棒内での歩行、次に松葉杖や歩行器を使用した歩行訓練を行い、最終的には杖なし歩行を目指します。
リハビリテーションの段階的目標一覧
| 時期 | 主な目標 | 具体的な取り組み内容 |
|---|---|---|
| 術直後〜2週間 | 合併症予防と関節可動域の維持 | 血栓予防のための足首運動、ベッド上での筋力トレーニング、許可された範囲での関節運動を行います。 |
| 術後2週間〜1ヶ月 | 荷重訓練と移動能力の向上 | 松葉杖や歩行器を用いた歩行練習を開始します。体重のかけ方を徐々に増やし、安定性を確認します。 |
| 術後1ヶ月〜退院 | ADL自立と応用動作の獲得 | 階段昇降、床からの立ち上がり、外出シミュレーションなどを行い、退院後の生活に適応する能力を養います。 |
股関節の筋肉(特に中殿筋などの外転筋)が切除されていると、歩行時に骨盤が傾く「トレンデレンブルグ歩行」などが残る場合がありますが、補装具の活用や残存筋力の強化によって、実用的な歩行能力の獲得を目指します。
術後早期から理学療法士が介入し、ベッドサイドでの訓練から開始します。
日常生活動作(ADL)の獲得と注意点
退院後の生活を見据え、トイレ動作、入浴、着替え、階段昇降などの日常生活動作(ADL)の練習を行います。
特に腫瘍用人工関節を入れた場合、股関節を深く曲げたり、内側に捻ったりする動作で脱臼するリスクが高まることがあります(脱臼肢位)。
どのような姿勢が危険かを理解し、生活環境(ベッドや椅子の高さ調整、洋式トイレの使用など)を整えることが重要です。
また、学校や職場への復帰については、通学・通勤の手段や活動内容について、医師やソーシャルワーカーと相談しながら環境調整を行います。
治療終了後の経過観察と長期的な健康管理
治療終了後は、局所再発や肺転移の早期発見に向けた定期的な検査を継続するとともに、晩期合併症や人工関節のメンテナンスを含む長期的な健康管理が必要です。
肺転移のモニタリングと対応
骨肉腫が転移しやすい臓器は肺です。血液の流れに乗って腫瘍細胞が肺に到達するためです。肺転移は初期には自覚症状がほとんどありません。
咳や呼吸困難が出た時にはかなり進行していることが多いため、症状がない段階でCT検査によって発見することが極めて重要です。
経過観察における推奨スケジュールと検査項目
| 経過年数 | 受診頻度の目安 | 主な検査内容 |
|---|---|---|
| 治療終了後 1〜2年目 | 3ヶ月に1回程度 | 胸部CT、単純X線(患部・胸部)、血液検査を重点的に行い、早期再発を警戒します。 |
| 3〜5年目 | 4ヶ月〜半年に1回程度 | 検査間隔を少し空けますが、引き続き肺転移と局所再発のチェックを継続します。人工関節の状態も確認します。 |
| 5年目以降 | 1年に1回程度 | 晩期合併症の有無や、人工関節の経年劣化、二次がんのスクリーニングを含めた全身管理を行います。 |
定期的な胸部CT検査を行い、小さな結節影が見つかった場合は、それが転移なのか、あるいは良性の変化なのかを慎重に評価します。
もし転移が見つかった場合でも、個数が少なく切除可能であれば、胸腔鏡手術などで積極的に切除することで長期生存が期待できます。
人工関節のメンテナンスと晩期合併症
腫瘍用人工関節は耐久性が向上していますが、若年者の場合、一生涯使い続けるには摩耗や破損、緩み(ルースニング)のリスクが伴います。
定期的なレントゲン検査で人工関節の状態を確認し、必要であれば部品交換や再置換手術を検討します。
また、化学療法の影響による晩期合併症として、不妊のリスクや心機能障害などがあります。
これらについては、循環器内科や生殖医療科などの専門科と連携し、全身の健康管理を継続していく視点が大切です。
Q&A
股関節の痛みが続くと骨肉腫ではないかと心配です。どのような痛みの時に受診すべきですか?
最も重視すべきサインは「安静時痛」と「夜間痛」です。
筋肉痛や軽い怪我であれば、安静にしていれば痛みは和らぎますが、骨肉腫の場合は休んでいても痛みが続いたり、夜寝ている時に痛みで目が覚めたりすることがあります。
また、1〜2週間以上痛みが引かない、徐々に強くなっているという場合も要注意です。成長痛と自己判断せず、整形外科でレントゲン検査を受けることを強くお勧めします。
手術をした後、以前のようにスポーツをすることはできますか?
手術の内容や切除した筋肉の範囲、再建方法によって大きく異なります。
腫瘍用人工関節を用いた場合、ジョギングや水泳、自転車などの軽い運動は可能になることが多いですが、コンタクトスポーツ(サッカーやラグビーなど)や、関節に過度な衝撃がかかる激しい運動は、人工関節の破損や脱臼のリスクがあるため制限されることが一般的です。
個々の患者さんの状態に合わせて、主治医や理学療法士が可能な運動範囲を指導します。
骨肉腫は遺伝するのでしょうか?兄弟も検査を受けたほうがいいですか?
大部分の骨肉腫は遺伝しません。偶発的に発生するものであり、兄弟や子供に遺伝する心配はほとんどありません。
ただし、ごく一部の遺伝性疾患(リ・フラウメニ症候群など)に関連して発生するケースがあります。
家系内に若くしてがんを発症した人が多いなどの特殊な事情がない限り、過度に心配して兄弟全員が精密検査を受ける必要はありません。
気になる場合は遺伝カウンセリング外来などで相談することも可能です。
成長痛と骨肉腫の痛みの見分け方はありますか?
完全に症状だけで見分けるのは難しい場合もありますが、いくつかの違いがあります。
成長痛は主に夕方から夜にかけて痛み、朝にはケロリとしていることが多く、痛む場所も日によって変わることがあります。
また、関節そのものではなく筋肉や腱の付着部を痛がることが多いです。一方、骨肉腫の痛みは場所が一定しており、日を追うごとに徐々に増強し、持続的であることが特徴です。
少しでも不安な点があれば、画像診断で確認することが確実です。
治療にかかる期間はどのくらいですか?
標準的な治療プロトコルでは、術前化学療法に約2〜3ヶ月、手術と術後の回復に約1ヶ月、術後化学療法に約4〜6ヶ月を要するため、トータルで約9ヶ月から1年程度の治療期間が必要となります。
この間は入院治療が中心となりますが、体調が良い時期には一時退院して自宅で過ごすことも可能です。
学校や仕事に関しては、長期の休学・休職が必要になることが多いため、医療ソーシャルワーカーを含めた早期の調整が必要です。
参考文献
WITTIG, James C., et al. Osteosarcoma: a multidisciplinary approach to diagnosis and treatment. American family physician, 2002, 65.6: 1123-1133.
FUCHS, Bruno, et al. Osteosarcoma of the pelvis: outcome analysis of surgical treatment. Clinical orthopaedics and related research, 2009, 467.2: 510-518.
BROWN, Jeffrey Mark, et al. Osteosarcoma of the pelvis: clinical presentation and overall survival. Sarcoma, 2021, 2021.1: 8027314.
GELLER, David S.; GORLICK, Richard. Osteosarcoma: a review of diagnosis, management, and treatment strategies. Clin Adv Hematol Oncol, 2010, 8.10: 705-718.
ERDOĞAN, Furkan, et al. Analysis of prognostic factors and histopathological response to neoadjuvant chemotherapy in osteosarcoma. Joint Diseases and Related Surgery, 2023, 34.1: 196.
WHELAN, J. S., et al. Survival from high-grade localised extremity osteosarcoma: combined results and prognostic factors from three European Osteosarcoma Intergroup randomised controlled trials. Annals of Oncology, 2012, 23.6: 1607-1616.
BIELACK, Stefan S., et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. Journal of clinical oncology, 2002, 20.3: 776-790.
ABOULAFIA, Albert J.; MALAWER, Martin M. Surgical management of pelvic and extremity osteosarcoma. Cancer, 1993, 71.S10: 3358-3366.
CARRLE, Dorothe; BIELACK, Stefan S. Current strategies of chemotherapy in osteosarcoma. International orthopaedics, 2006, 30.6: 445-451.
RITTER, Jörg; BIELACK, S. S. Osteosarcoma. Annals of oncology, 2010, 21: vii320-vii325.
Symptoms 症状から探す